Arabella Essert, M.Sc. – Funktionalisierung von DNA-Nanostrukturen
Arabella Essert, M.Sc. – Funktionalisierung von DNA-Nanostrukturen
Durch den Einsatz von Enzymen, die konsekutive Reaktionen katalysieren, können organische Verbindungen unter milden Reaktionsbedingungen effizient und nachhaltig produziert werden. Natürliche Vorbilder für solche mehrstufigen Reaktionskaskaden sind die metabolischen Synthesewege natürlicher Zellen, deren Effizienz mit artifiziellen Systemen kaum erreicht werden kann. Ein Grund hierfür ist die Erhöhung der Reaktionsgeschwindigkeiten durch die Ausbildung von multiplen Proteinkomplexen oder die Immobilisierung auf Protein-Gerüststrukturen, sogenannten ‚Scaffolds‘, die eine unkontrollierte Diffusion der Intermediate in die Umgebung einschränken. Die auf diese Weise lokal erhöhten Intermediatkonzentrationen führen dann zu höheren Geschwindigkeiten der Folgereaktionen.
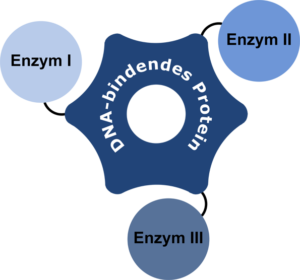
Aufgrund der anhaltenden wissenschaftlichen Debatte, inwiefern solche Substratkanäle auch künstlich erzeugt werden können, sollen in diesem Projekt verschiedene DNA-Nanostrukturen durch die Anbindung von Enzymen funktionalisiert werden, um die Auswirkungen auf die Reaktionsraten zu untersuchen. Mit Hilfe eines DNA-bindenden Proteins sollen Enzyme einer mehrstufigen Reaktionskaskade zur direkten Umsetzung der Intermediate in räumliche Nähe zueinander gebracht werden. Hierzu werden Fusionsproteine aus einem DNA-bindenden Protein und den jeweiligen Enzymen generiert, rekombinant in Escherichia coli hergestellt und an maßgeschneiderten DNA-Nanostrukturen mit unterschiedlicher räumlicher Orientierung immobilisiert. Im Anschluss werden diese verschiedenen Enzymsysteme mit dem entsprechenden freien Enzymsystem verglichen.
Veröffentlichungen:
Essert A, Castiglione K (2024): Dimer Stabilization by SpyTag/SpyCatcher Coupling of the Reductase Domains of a Chimeric P450 BM3 Monooxygenase from Bacillus spp. Improves its Stability, Activity, and Purification. Chem Bio Chem, 25, e202300650.
Essert A, Castiglione K (2023): Enhancing the activity of a monomeric alcohol dehydrogenase for site-specific applications by site-directed mutagenesis. PEDS, 36, gzad006.
Schorn F, Essert A, Zhong Y, Abdullayev S, Castiglione K, Haumann M, Joly N (2023): Measurement of Minute Liquid Volumes of Chiral Molecules Using In-Fiber Polarimetry. Anal. Chem., 95, 6, 3204–3209.